আমি একজন পেশাদার বাংলা কনটেন্ট রাইটার এবং এই নিবন্ধটিতে আমি ইথানল এবং পানির দ্রাবকতা সম্পর্কে আলোকপাত করব। এই নিবন্ধে, আমরা ইথানল এবং পানি কী তা আলোচনা করব, দ্রাবকতা কী, এবং ইথানল কেন পানিতে দ্রবণীয়। আমরা এই দুটি যৌগের আণবিক বন্ধন এবং তাদের পারস্পরিক ক্রিয়াকেও পরীক্ষা করে দেখব। এই নিবন্ধটি পড়ার পর, আপনি ইথানল এবং পানির দ্রাবকতার মৌলিক বিষয়গুলি বুঝতে সক্ষম হবেন এবং এই জ্ঞানটি বিভিন্ন ক্ষেত্রে কীভাবে প্রয়োগ করা যায় তাও জানতে পারবেন।
ইথানল কি?
এইচএফ একটি পোলার দ্রাবক কারণ এতে হাইড্রোজেন এবং ফ্লোরিন মধ্যে একটি উচ্চ বৈদ্যুতিন নেগেটিভিটির পার্থক্য রয়েছে। এই নেগেটিভিটি ডিফারেন্সের কারণে হাইড্রোজেন এবং ফ্লোরিন পরমাণুর মধ্যে একটি মেরুক শক্তি তৈরি করে, যা হাইড্রোজেন পরমাণুতে আংশিক ধনাত্মক চার্জ এবং ফ্লোরিন পরমাণুতে আংশিক ঋণাত্মক চার্জের সৃষ্টি করে। এই মেরুক শক্তি এইচএফ অণুগুলিকে দ্বিমের গঠন করতে বাধ্য করে, যেখানে বিপরীতভাবে চার্জ হওয়া অণুগুলি একে অপরকে আকর্ষণ করে। এই দ্বিমেরগুলি পানির মতো অন্যান্য মেরুক দ্রাবকে দ্রবীভূত হতে সক্ষম করে, যার ফলে এটা একটি পোলার দ্রাবক হিসাবে কাজ করে।
পানি কি?
পানি হলো পৃথিবীর উপরিভাগে পাওয়া সবচেয়ে প্রচুরতম যৌগ। এটি আমাদের নদী, হ্রদ এবং মহাসাগরগুলো গঠন করে এবং এটি আমাদের দেহেরও একটি গুরুত্বপূর্ণ অংশ। পানি হলো একটি অণু যা দুটি হাইড্রোজেন পরমাণু এবং একটি অক্সিজেন পরমাণু দ্বারা গঠিত। এটি স্বচ্ছ, স্বাদহীন এবং গন্ধহীন। পানি দ্রাবক হিসেবে কাজ করে, অর্থাৎ এটি অন্য অনেক পদার্থকে দ্রবীভূত করতে পারে। পানি খুব গুরুত্বপূর্ণ কারণ এটি আমাদেরকে জীবিত থাকতে সাহায্য করে এবং আমাদের পরিবেশের জন্যও এটি গুরুত্বপূর্ণ।
দ্রাবকতা কি?
দ্রাবকতা হলো একটি পদার্থের নির্দিষ্ট তাপমাত্রায় একটি দ্রাবকে দ্রবীভূত হওয়ার ক্ষমতা। একটি পদার্থের দ্রাবকতা তার আণবিক গঠন, দ্রাবকের আণবিক গঠন এবং তাপমাত্রার উপর নির্ভর করে। একটি পদার্থের দ্রাবকতা যত বেশি হবে, তা দ্রাবকে তত বেশি পরিমাণে দ্রবীভূত হবে। দ্রাবকতার একক হলো গ্রাম/লিটার (g/L) বা মোলারিটি (M)।
কেন ইথানল পানিতে দ্রবণীয়?
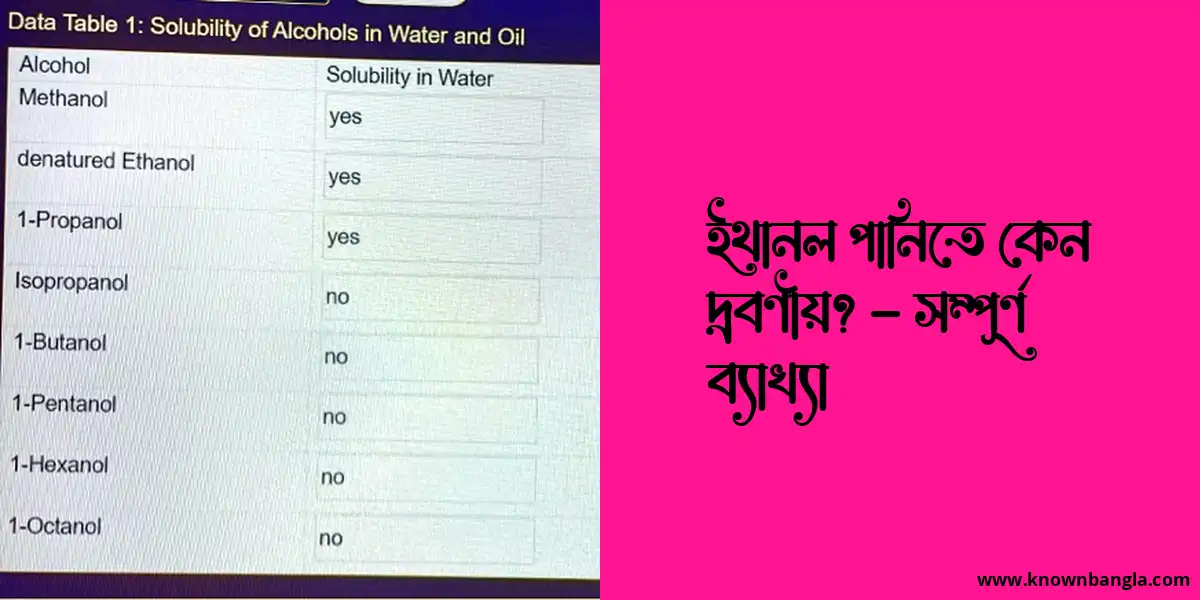
ইথানল পানিতে দ্রবণীয় কারণ এটি একটি মেরু অণু। ইথানল অণুর অক্সিজেন পরমাণুতে একটি আংশিক ঋণাত্মক চার্জ রয়েছে এবং কার্বন পরমাণুতে একটি আংশিক ধনাত্মক চার্জ রয়েছে। পানির অণুগুলিও মেরু, অক্সিজেন পরমাণুতে একটি আংশিক ঋণাত্মক চার্জ এবং হাইড্রোজেন পরমাণুতে একটি আংশিক ধনাত্মক চার্জ থাকে। বিপরীত চার্জগুলি একে অপরকে আকর্ষণ করে, যা ইথানল এবং পানির অণুগুলির মধ্যে হাইড্রোজেন বন্ধ তৈরি করে। এই হাইড্রোজেন বন্ধ ইথানলকে পানিতে দ্রবীভূত হতে সাহায্য করে।
ইথানল কেন পানিতে দ্রবণীয়?
ইথানল, অ্যালকোহলের একটি সদস্য, পানিতে অত্যন্ত দ্রবণীয়। এটি অ্যালিফ্যাটিক, স্যাচুরেটেড অ্যালকোহলগুলির প্রথম সদস্য। এটি ইথিল অ্যালকোহল, পানীয় অ্যালকোহল বা কেবল অ্যালকোহল হিসাবেও পরিচিত। এটি একটি তরল পদার্থ যা জ্বলনশীল এবং একটি সুগন্ধযুক্ত গন্ধযুক্ত। রাসায়নিক বন্ধনের প্রকৃতির কারণে এটি পানিতে দ্রবণীয়। ইথানলের অণুতে একটি হাইড্রোফিলিক, পানি-প্রেমময় অংশ এবং একটি হাইড্রোফোবিক, পানি-বিদ্বেষী অংশ রয়েছে। পানির অণুগুলির অক্সিজেন পরমাণু হাইড্রোফিলিক গ্রুপের সাথে হাইড্রোজেন বন্ড গঠন করে। একইভাবে, ইথানলের হাইড্রোফোবিক গ্রুপগুলি অন্যান্য ইথানল অণুগুলির সাথে লন্ডন ছড়িয়ে থাকা শক্তির মাধ্যমে যোগাযোগ করে। এই মিথস্ক্রিয়াগুলি ইথানল এবং পানিকে মিশ্রিত হতে দেয়, একটি সমজাতীয় দ্রবণ গঠন করে।
ইথানল এবং পানির আণবিক বন্ধন
এতটা শক্তিশালী কেন? এর কারণ হল হাইড্রোজেন বন্ধন। হাইড্রোজেন বন্ধন হল একটি আন্তঃআণবিক বল যা একটি হাইড্রোজেন পরমাণুর এবং একটি অত্যন্ত বৈদ্যুতিন-ঋণাত্মক পরমাণুর, যেমন অক্সিজেন, ফ্লোরিন বা নাইট্রোজেনের মধ্যে তৈরি হয়। হাইড্রোজেন বন্ধন ের জন্য দায়ী, যা তাদের একে অপরের সাথে মিশ্রিত হতে দেয়।
একটি হাইড্রোজেন বন্ধন তৈরি হয় যখন একটি হাইড্রোজেন পরমাণুর একটি অত্যন্ত বৈদ্যুতিন-ঋণাত্মক পরমাণুর সাথে একটি সহযোজী বন্ধন তৈরি করে। এই অসম বন্ধন হাইড্রোজেন পরমাণুর একটি আংশিক ধনাত্মক চার্জ এবং অত্যন্ত বৈদ্যুতিন-ঋণাত্মক পরমাণুর একটি আংশিক ঋণাত্মক চার্জের দিকে পরিচালিত করে। এই আংশিক চার্জগুলি পরস্পর আকর্ষণ করে, যা দুটি আণবিককে একসাথে রাখে।
ইথানলের ক্ষেত্রে, হাইড্রোজেন পরমাণুর অক্সিজেন পরমাণুর সাথে একটি সহযোজী বন্ধন তৈরি করে। এই বন্ধনটি অসম, যা অক্সিজেন পরমাণুর একটি আংশিক ঋণাত্মক চার্জ এবং হাইড্রোজেন পরমাণুর একটি আংশিক ধনাত্মক চার্জের দিকে পরিচালিত করে। পানির ক্ষেত্রে, হাইড্রোজেন পরমাণুগুলি অক্সিজেন পরমাণুর সাথেও সহযোজী বন্ধন তৈরি করে। এই বন্ধনগুলিও অসম, যা অক্সিজেন পরমাণুর একটি আংশিক ঋণাত্মক চার্জ এবং হাইড্রোজেন পরমাণুগুলির আংশিক ধনাত্মক চার্জের দিকে পরিচালিত করে।
ইথানল এবং পানির মধ্যে হাইড্রোজেন বন্ধন পরস্পর আকর্ষণ করে, যা দুটি আণবিককে একসাথে রাখে। এটিই ইথানলকে পানিতে দ্রবণীয় করে তোলে।
ইথানল এবং পানির পারস্পরিক ক্রিয়া
এথানল এবং পানির মিথস্ক্রিয়া একটি জটিল প্রক্রিয়া যা পদার্থের বেশ কয়েকটি গুরুত্বপূর্ণ বৈশিষ্ট্যকে প্রভাবিত করে। প্রথমত, এথানল পানিতে দ্রবণীয় কারণ এটি একটি মেরুযুক্ত অণু। এথানলের হাইড্রোক্সিল (-OH) গ্রুপটি অক্সিজেন পরমাণুতে আংশিক ঋণাত্মক চার্জ এবং হাইড্রোজেন পরমাণুতে আংশিক ধনাত্মক চার্জ তৈরি করে। এই মেরুতা এথানলকে পানির মতো অন্যান্য মেরুযুক্ত অণুগুলির সাথে হাইড্রোজেন বন্ধন তৈরি করতে দেয়, যার ফলে দুটি পদার্থের মিশ্রণে একটি একজাতীয় দ্রবণ তৈরি হয়।
উপরন্তু, এথানল এবং পানির মিশ্রণটি একটি ইউটেকটিক মিশ্রণ তৈরি করে, যা একটি নির্দিষ্ট তাপমাত্রা এবং সংকোচনতে দুটি পদার্থের সর্বনিম্ন দ্রবণ দ্রবণ তৈরি করে। এই ইউটেকটিক মিশ্রণটি বিভিন্ন শিল্প প্রক্রিয়ায় একটি শীতলক বা একটি ক্রায়োপ্রোটেক্ট্যান্ট হিসাবে ব্যবহৃত হয়। পানিতে এথানলের দ্রাব্যতা তাপমাত্রা এবং চাপের সাথে পরিবর্তিত হয়, উচ্চ তাপমাত্রা এবং নিম্ন চাপের সাথে দ্রাব্যতা বাড়ে। এছাড়াও, লবণ এবং অন্যান্য অমেধ্য পদার্থের উপস্থিতি এথানলের দ্রাব্যতাকে হ্রাস করতে পারে।






Leave a Reply